Seguridad y eficacia del uso del propofol en infusión continua para la sedación en procedimientos endoscópicos prolongados y/o complejos.
Rosa Virginia Acosta Materán, Concepción Piñero Pérez, Renzo Calderón Begazo, Ana Mora Soler, Yuliana Jamanca Poma, Daniel Pérez Corte, Cristina Revilla Morato, Héctor Marcos Prieto, Antonio Velasco Guardado, Alberto Álvarez Delgado, Antonio Rodríguez Pérez.
Servicio de Aparato Digestivo. Hospital Universitario de Salamanca.
RESUMEN
La sedación con propofol por profesionales sanitarios con formación adecuada es segura y efectiva en endoscopia. Sin embargo, no hay estudios prospectivos comparando efectividad y coste en la sedación con propofol con y sin anestesiólogo. El objetivo de este estudio consiste en comprobar si con un sólo endoscopista (a veces ayudado por un residente) y 2 profesionales de enfermería (incluyendo auxiliar) se pueden realizar de forma segura y eficaz exploraciones largas (CPRE, Enteroscopia y Ecoendoscopia) con sedación profunda en perfusión continua y conocer las complicaciones durante la sedación. Método. Estudio prospectivo de 246 pacientes con indicaciones de CPRE, USE y enteroscopia incluídos desde agosto 2012 a marzo 2013 en la Unidad de Endoscopias del Servicio de Aparato Digestivo del Hospital Clínico Universitario de Salamanca. El personal en la sala consistió en un endoscopista, un profesional de enfermería con experiencia en sedoanalgesia y reanimación cardiopulmonar (RCP), un/a auxiliar de enfermería y en ocasiones un médico interno residente (MIR) de aparato digestivo. Se clasificaron según los criterios de la Sociedad Americana de Anestesistas (ASA). Resultados. Los procedimientos realizados fueron 160 CPRE (64%), 70 ecoendoscopias (29%) y 16 enteroscopias (7%). La dosis total media de propofol fue de 320,64±145,47 mg. En 9 casos (3,6%) se asoció Fentanilo y en 4 casos (1,6%) Midazolam. El tiempo de recuperación completa posterior al procedimiento fue de 11,2 ± 6 minutos. Se registraron 12 casos (4,8%) de desaturación leve (entre 85 y 91%), 10 casos (4,1%) de hipotensión(<90/50mmHg), 7 casos (2,8%) de taquicardia (>90 lpm), 6 casos (2,4%) de bradicardia (<70lpm) y 50 casos (20,3%) de hipertensión(>140/90 mmHg), todos ellos transitorios. No se requirió en ningún caso la realización de maniobras de resucitación cardiopulmonar, administración de fármacos antagonistas, intubación orotraqueal ni asistencia por anestesiólogo ni intensivista. Conclusión. La realización de endoscopias “prolongadas y/o complejas” con sedación profunda en perfusión continua llevadas a cabo por un facultativo especialista en endoscopias, con ayuda exclusivamente de un profesional de enfermería con experiencia en sedoanalgesia y RCP y un/a auxiliar es segura y eficaz.
PALABRAS CLAVE Propofol, perfusión continua, seguridad, enteroscopia, ecoendoscopia, colangiografía retrógrada endoscópica.
ABREVIATURAS CPRE: colangiopancreatografía retrógrada endoscópica. USE: ecoendoscopia MIR: Médico Interno Residente. ASA: American society of anesthesiologist RCP: Reanimación cardiopulmonar
INTRODUCCIÓN
En los últimos años los procedimientos endoscópicos terapéuticos como la CPRE, enteroscopia y ecoendoscopia se han desarrollado más y por ende han aumentado de forma importante su demanda en las unidades de endoscopias. La sedación profunda en este tipo de procedimientos diagnósticos y terapéuticos ha de considerarse, empleándose para ello una bomba de infusión continua de propofol precedido por una pauta de inducción de la sedación con la administración de un bolo de propofol, lográndose así el nivel de sedación requerido. La sedación profunda minimiza el movimiento del paciente facilitando la manipulación con mayor precisión y poca interrupción. Por otro lado, el propofol ha sido aceptado por las diferentes sociedades científicas como fármaco en el protocolo de sedación con un buen perfil de seguridad, su efecto sedante y amnésico, un corto tiempo de recuperación y su rápida acción son características favorables que han aumentado su uso en endoscopia. La sedación con propofol por profesionales sanitarios con formación adecuada es segura y efectiva en endoscopia (1). Sin embargo, existen pocos estudios prospectivos comparando efectividad y coste en la sedación con propofol con y sin anestesiólogo (2). En nuestro centro contamos con amplia experiencia en la administración de sedación vigilada por el mismo endoscopista y personal de enfermería que realizan la exploración, sin que hayamos tenido problemas para el paciente y sin repercusión en el éxito de la exploración, con el consiguiente ahorro para la institución. Esto se ha protocolizado y se cuenta con la ayuda de personal médico en las salas vecinas que pueden ayudar con rapidez ante un problema. El objetivo de este estudio consiste en comprobar si con un sólo endoscopista (a veces ayudado por un residente de la especialidad) un profesional de enfermería y un/a auxiliar se pueden realizar de forma segura y eficaz exploraciones largas (CPRE, enteroscopia y ecoendoscopia) con sedación profunda en infusión continua y conocer las complicaciones durante la sedación.
MATERIAL Y MÉTODO
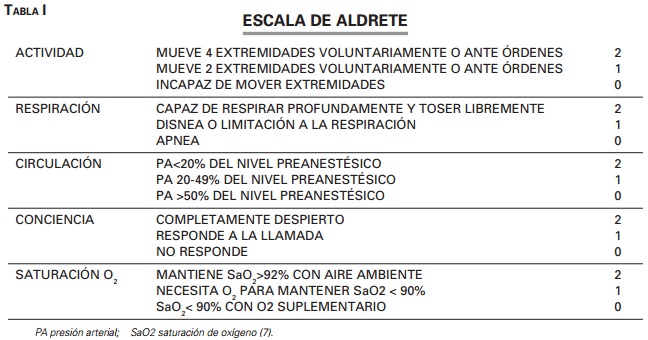
Estudio prospectivo observacional de los resultados y complicaciones en CPRE, USE y enteroscopia con sedación mediante propofol en perfusión continua desde agosto 2012 a marzo 2013 en la Unidad de Endoscopias del Servicio de Aparato Digestivo del Hospital Universitario de Salamanca. El análisis estadístico se realizó mediante el paquete estadístico SPSS 22.0, aplicándose el test ANOVA para análisis multivariante de la varianza. Se estudiaron 246 pacientes con una edad media de 70,04 años, DT: ±15,56. El 56,5% eran hombres y el 43,5% mujeres; todos firmaron el consentimiento informado previo al estudio y para la realización del procedimiento. Los criterios de exclusión fueron edad < 17 años, embarazo o negativa a la sedación. Se estratificó el riesgo según la Asociación Americana de Anestesistas (ASA). Se rellenó un listado antes y después de cada procedimiento incluyendo alergias farmacológicas, tratamientos previos, enfermedades, constantes, cuidados tras la exploración. Se empleó la Escala de Aldrete (ver Tabla 1) para dar el alta al paciente de la sala de recuperación posterior al procedimiento con una puntuación superior o igual a 9 puntos. El personal en la sala consistió en un endoscopista, un profesional de enfermería con experiencia en sedoanalgesia y reanimación cardiopulmonar (RCP), un/a auxiliar de enfermería y en ocasiones un residente de aparato digestivo; otro facultativo estaba vigilante dentro de la Unidad de Endoscopia con conocimientos en sedación y manejo de soporte vital avanzado, disponible para cualquier incidente que se presentara en la sala. El propofol fue el fármaco usado para la sedación profunda, siendo la pauta de inducción de propofol en bolo inicial 0,5-1 mg/kg de peso según edad y con un ritmo de perfusión en bomba (9-12 mg/kg/hora). Se utilizaron dosis bajas de inducción y mantenimiento en pacientes mayores de 60 años a criterio del especialista en aparato digestivo. Se asoció fentanilo intravenoso (dosis 75-150 ucg) y/o midazolam intravenoso (dosis 3-5 mg) a juicio del facultativo de aparato digestivo, en casos especiales bien por dolor o por comorbilidad (según el Indice de comorbilidad de Charlson) con el fin de disminuir la dosis de propofol. Todos los pacientes recibieron oxígeno de alto flujo VMK al 31%. Se monitorizaron los parámetros cardiovasculares, con pulsioximetría y medición de la presión arterial al primer minuto y posteriormente con intervalos de 5 minutos durante el procedimiento. El personal de enfermería administró el fármaco bajo la supervisión del médico que realizó el procedimiento. El nivel de sedación utilizado en todas las exploraciones fue la sedación profunda evaluada mediante la escala de Sedación de Ramsay (3) cada 15 min por un/a auxiliar de enfermería. El equipo de reanimación estuvo disponible en todo momento dentro de la sala de endoscopia, además se contó con un teléfono dentro de la misma para llamadas de emergencia a salas vecinas o a la UVI situada adyacente a nuestro servicio.

Se definieron como exploraciones “largas” y/o complejas a la CPRE, ecoendoscopia y enteroscopia, independientemente de su duración al hacerlo “a priori”. Todos los procedimientos fueron realizados por los 3 endoscopistas de la Unidad, expertos en la técnica (con más de 300 exploraciones largas y complejas por año) con conocimientos en sedoanalgesia, reanimación cardiopulmonar y otras medidas de soporte vital, adquiridos a través de la realización de cursos formativos certificados. En cuanto a los eventos relacionados con la sedación se definió hipoxemia leve transitoria como la disminución de la saturación de oxígeno menor a 91% durante al menos 30 segundos, corrigiéndose con aumento del flujo de oxígeno o disminución de la tasa de infusión del propofol. La hipotensión arterial se consideró a una disminución de la presión arterial por debajo de 90/50 mmHg y si aparecía se procedía a corregirla con una infusión más rápida de suero salino o una disminución de la tasa de infusión. Se definió como desaturación grave la disminución de la saturación de O2 por debajo de 85%, la hipertensión como la elevación de las cifras tensionales (>140/90 mmHg). No hubo necesidad de intervención de facultativo anestesista o intensivista en ninguna sedación. La duración del procedimiento fue el tiempo transcurrido desde la administración de la sedación hasta la retirada del endoscopio. La recuperación estuvo controlada por un auxiliar y un/a enfermero/a hasta que el paciente cumpliera todas las condiciones de la clasificación de Aldrete para ser dado de alta.
RESULTADOS
Se incluyeron 246 exploraciones realizadas a 246 pacientes, excluyéndose del estudio los pacientes menores de edad y los pacientes que no firmaron el consentimiento informado; edad media 70,04 ±15,56 años. El 56,5% eran hombres y el 43,5% mujeres. Los procedimientos realizados fueron (Figura 1) 160 CPRE (64%), 70 ecoendoscopias (29%) y 16 enteroscopias (7%). En cuanto a la Clasificación ASA (Figura 2): 42 pacientes ASA I (17%), 134 ASA II (54,4%), 59 ASA III (24%) y 11 ASA IV (4,5%). Un paciente (0,4%) tenía malformaciones faciales y otro cuello corto (0,4%). La duración media de las exploraciones fue 40 ±27 minutos. La dosis total media de propofol fue de 320,64±145,47 mg; sólo se asoció en 9 casos (3,6%) fentanilo (dosis 75-150 ucg) y en 4 casos (1,6%) midazolam (dosis 3-5 mg) en casos de pacientes con edad avanzada y con mayor comorbilidad. Todos los pacientes alcanzaron un nivel de sedación profunda según la escala de Ramsay evaluándose cada 15 min. los parámetros por el personal de enfermería presente en la sala. El tiempo de recuperación completa posterior al procedimiento fue de 11,2 ± 6 minutos.

Figura 1.- Prodcedimientos endoscópicos

Figura 2.- Clasificación ASA.
Las complicaciones de la sedación fueron (Figura 3) 34,4%; se registraron 12 casos (4,8%) de desaturación leve (entre 85 y 91%), 10 casos (4,1%) de hipotensión (inferior a 90/50 mmHg), 7 casos (2,8%) de taquicardia (>90 lpm), 6 casos (2,4%) de bradicardia(<60 lpm) y 50 casos (20,3%) de hipertensión (>140/90 mmHg), todos ellos transitorios y revertidos mediante apertura de la vía aérea con cánula de Guedel y/o ventilación manual con Ambú, intensificación del aporte de oxígeno. Un paciente presentó desaturación grave, otros dos pacientes presentaron desaturación e hipotensión. Encontramos relación entre la desaturación durante el procedimiento con la saturación <91% antes de la prueba, con pacientes con puntuación alta en la clasificación ASA y con la duración de la prueba. La desaturación después de la exploración estaba relacionada con la saturación baja antes de la prueba, la duración del procedimiento y edad del paciente. La hipotensión durante la prueba con pacientes con comorbilidad, hipotensión antes de la prueba y asociación de midazolam con propofol durante el procedimiento.

Figura 3.- Complicaciones durante la sedación.
No se requirió en ningún caso la realización de maniobras de resucitación cardiopulmonar, administración de fármacos antagonistas, intubación orotraqueal ni asistencia por anestesiólogo/a ni intensivista. Ningún procedimiento se interrumpió por la presencia de complicaciones relacionadas con la sedación.
DISCUSIÓN
El uso de propofol para la sedación endoscópica por personal no anestesista ha aumentado considerablemente durante la última década, los datos de encuestas recientes indican que la sedación con propofol se asocia con un menor riesgo de complicaciones y efectos adversos graves durante la endoscopia estándar en comparación con la sedación convencional (4). La seguridad y eficacia del propofol para otros procedimientos endoscópicos terapéuticos complejos, como la colangiopancreatografía retrógrada endoscópica y la ecografía endoscópica, se ha establecido en varios estudios (1,5,6). Algunos de ellos han puesto de manifiesto que los efectos adversos durante el procedimiento, asociados a la sedación con propofol son leves y transitorios (7,8). Las dosis bajas de inducción de propofol también pueden conducir a una baja incidencia de eventos adversos. Un punto de importancia clínica en nuestro estudio es que el profesional de enfermería capacitado administró el propofol, bajo la supervisión de un endoscopista experto en el procedimiento y con conocimientos en sedación. Recientes ensayos a gran escala señalan que el personal de enfermería entrenado adecuadamente en la administración de la sedación con propofol puede ayudar al endoscopista en la administración de la sedación y en el seguimiento del paciente durante el procedimiento, con el ahorro consecuente de recursos (9,10). Nuestro estudio mostró una incidencia de complicaciones cardiorrespiratorias de 34,4 %, elevada, en contraste con otros trabajos publicados (11) sin embargo, es importante resaltar que en la serie publicada hace mención a complicaciones graves y frecuentes y de nuestros casos sólo 3 fueron graves: un caso de desaturación grave y dos casos con asociación de dos complicaciones (hipotensión y desaturación); destacando que todas las demás complicaciones registradas que tuvimos fueron transitorias y en ninguna se requirió la intervención de anestesista ni intensivista. Otro punto que merece valoración es que la incidencia de desaturación descrita en estudios (11) es muy variable (5-50%) datos que coinciden con nuestros resultados. Existen limitaciones en nuestro estudio. En primer lugar, los pacientes de más alto riesgo (ASA categoría V) fueron excluidos, y la proporción de pacientes ASA categoría III y IV era pequeña. Por último, no se comparó directamente la infusión continua de propofol y la inyección de propofol en bolo intermitente, por lo que se requieren más estudios para obtener un protocolo de sedación más eficaz y seguro por infusión continua de propofol dirigido por endoscopista y administrado por personal de enfermería durante procedimientos complejos y prolongados. Aunque la administración de la sedación por profesional sanitario no anestesista siga siendo tema de debate en este tipo de procedimientos puede considerarse un método seguro con un mínimo de personal (endoscopista, enfermera/o y auxiliar) siempre que la formación y el uso de medidas de emergencia para contrarrestar los efectos adversos de la sedación sea la adecuada. Con el uso de un sistema de control adecuado, los procedimientos endoscópicos pueden ser seguros y eficientes sin la presencia de acontecimientos adversos graves con propofol. La combinación de infusión continua de propofol con midazolam o fentanilo inyectable intravenoso de forma intermitente pueden disminuir la incidencia de los efectos adversos del propofol. Por último, un reducido número de personal en la sala de endoscopias con un entrenamiento adecuado en sedoanalgesia y el equipo necesario reduciría costes sin complicaciones graves durante los procedimientos.
BIBLIOGRAFÍA
1. Frieling T, Heise J, Kreysel C, Kuhlen R, Schepke M. Seda – tion-associated complications in endoscopy–prospective multicentre survey of 191142 patients. Z Gastroenterol 2013 Jun;51(6):568-72.
2. Poincloux L, Laquière A, Bazin J, Monzy F, Artigues F, Bonny Corinne, Abergel A, Dapoigny m, Bommelaer G. A randomized controlled trial of endoscopist vs. Anaesthetist-administered sedation for colonoscopy. Digestive Endoscopy. Digestive and Liver Disease (2011); 43: 553-8.
3. Ramsay MA, Savege TM, Simpson BR, Goodwin R. Contro – lled sedation with alphaxalone-alphadolone. BMJ 1974;22: 656-9.
4. Cohen LB. Nurse-administered propofol sedation for upper endoscopic ultrasonography: not yet ready for prime time. Nat Clin Pract Gastroenterol Hepatol 2009 Feb;6(2):76-7.
5. Yusoff I, Raymond G, Sahai A. Endoscopist administered pro – pofol for upper-GI EUS is safe and effective: a prospective study in 500 patients. 2004 Sep;60(3):356-60.
6. Jung M, Hofmann C, Kiesslich R, Brackertz A. Improved seda – tion in diagnostic and therapeutic ERCP: propofol is an alterna – tive to midazolam. Endoscopy 2000 Mar;32(3):233-8.
7. Seung Yeon C, Kyoung Kim O, Seon Dong P, Seong Yeol K, Ji Won P, Il Hyun B, et al. Nonanesthesiologist de disección endoscópica de la submucosa gástrica. Hígado Gut octubre 2012; 6 (4): 464-70 Publicado en Internet el 18 de octubre 2012.
8. Sipe BW, Rex DK, Latinovich D, Overley C, Kinser K, Bratcher L, et al. Propofol versus midazolam/meperidine for outpatient colonoscopy: administration by nurses supervised by endos – copists. Gastrointest Endosc 2002 Jun;55(7):815-825.
9. Heuss L, Walker J, Qi R. Enfermeros entrenados / equipos de endoscopia registrados pueden administrar propofol de manera segura para la endoscopia. . Gastroenterology 2005; 129:1384-1391 ;129:1384-1391.
10. Overley C, Kinser Kea. Seguridad de propofol administrado por enfermeras registradas con la supervisión gastroenterólo – go en 2.000 casos endoscópicos . Am J Gastroenterol 2002; 97 :1159-1163 2002;1159-1163.
11. Igea F, Casellas J, González-Huix F, Gómez-Oliva C, et al. Se – dación en endoscopia digestiva. Guía de práctica clínica de la Sociedad Española de Endoscopia Digestiva. Rev Esp Enferm Dig 2014; 106 (3):195-211.