ADENOCARCINOMA PAPILAR SEROSO PRIMARIO DEL EPIPLÓN MAYOR: “OMENTAL CAKE”. PRESENTACIÓN DE UN CASO
Mª Belén Rodríguez Sanz
Servicio de Cirugía General y del Aparato Digestivo. Complejo Asistencial de Ávila.
RESUMEN
El adenocarcinoma papilar seroso primario del peritoneo es una entidad maligna rara que afecta a mujeres predominantemente postmenopáusicas. Se trata de una patología indistinguible de la carcinomatosis peritoneal del carcinoma de ovario.
Se debe plantear el diagnostico diferencial con otras patologías como el mesotelioma peritoneal maligno que se asocia con la exposición al asbesto, tuberculosis peritoneal, linfomatosis peritoneal y sobre todo con la carcinomatosis de ovario.
Presentamos un caso clínico de una mujer de 66 años con carcinoma peritoneal primario en el epiplón mayor.
PALABRAS CLAVE
Carcinoma peritoneo. Omental Cake.
INTRODUCCIÓN
El omento o epiplón mayor es el pliegue peritoneal de mayor tamaño en el abdomen. Es la continuación del ligamento gastrocólico y está formado por una doble reflexión del mesogastrio dorsal, por lo tanto se compone de cuatro hojas de peritoneo.
“Omental cake” se define como engrosamiento anormal del epiplón mayor. Es una infiltración de la grasa omental, típicamente causada por infiltración de tumores metastásicos como estómago, ovario o colon; aunque también se infiltra por tuberculosis peritoneal, linfomas, o de forma primaria, por tumores de carácter neoplásico.
El carcinoma papilar seroso primario del peritoneo (CPSPP) es una neoplasia rara cuya incidencia se estima es de 6.8 casos por millón de habitantes (1). Fue descrito por primera vez por Swerdlow en 1959 (2), pero es en 1977 cuando Kannerstein y col. establecen criterios de diferenciación con el mesotelioma maligno (3).
Se cree que deriva del revestimiento mesotelial de la pelvis extraovárica y región inferior del abdomen, se considera una entidad patológica de origen mülleriano (4-5).
Se han descrito varios tipos histológicos, pero seroso es el más frecuente (6-7), esta variante como la que presentamos en nuestro caso clínico se asocia más frecuentemente con factores pronósticos desfavorables como invasión linfovascular, penetración miometrial profunda, metástasis ganglionares y mala evolución.
Se caracteriza por afectación masiva del peritoneo con escasa o nula afectación de la superficie del ovario, incluso puede desarrollarse en mujeres con ooforectomía bilateral previa independientemente de su patología benigna o maligna. (8)
Debido al origen embriológico común del mesotelio del peritoneo y el epitelio germinal del ovario, las características clínicas e histológicas del CPSPP son casi indistinguibles a las del carcinoma papilar seroso del ovario.
CASO CLÍNICO
Mujer de 66 años de edad con antecedentes de hipertensión arterial, valvulopatía mitral, hipertensión pulmonar y parálisis diafragmática. Acude al servicio de urgencias por cuadro de dolor abdominal supraumbilical inespecífico y distensión abdominal de dos meses de evolución.
En la analítica solo destaca la discreta-moderada elevación del CA 125 con un valor de 237 U/ml siendo los marcadores tumorales CEA, CA 19.9, CA 15.3, alfafetoproteína y BHGC normales.
En la exploración física: abdomen globuloso, blando y depresible doloroso a la palpación difusa principalmente en hemiabdomen superior sin defensa ni signos de irritación peritoneal. Se palpa engrosamiento difuso-masa en mesogastrio.
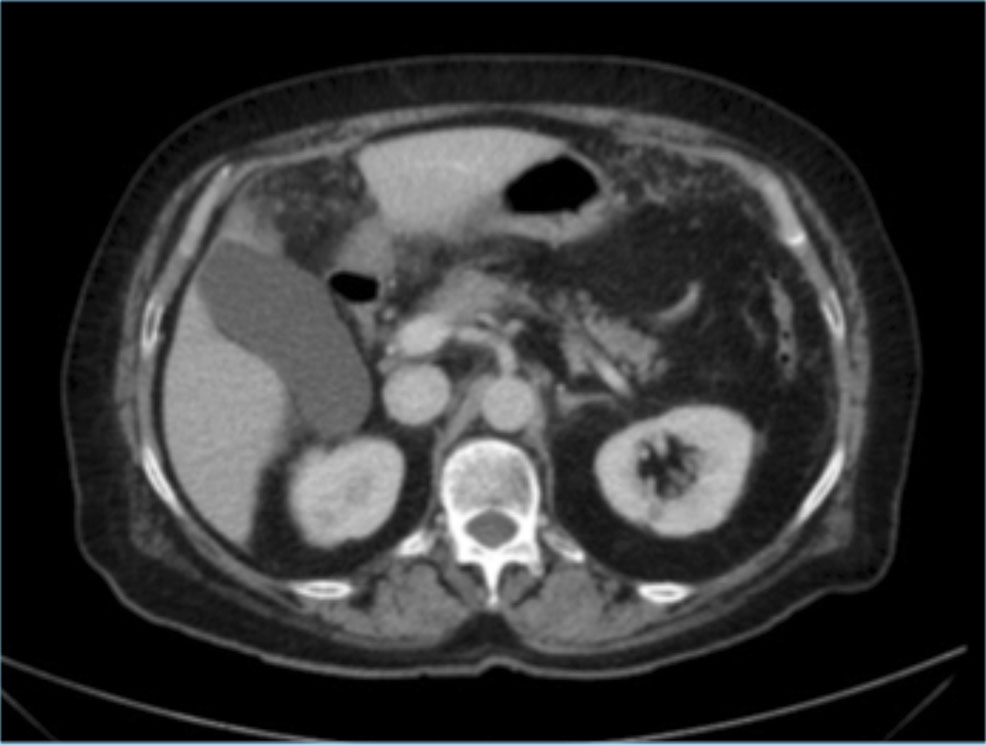
Se realiza TAC abdominal con presencia de inflamación irregular de la pared anterior, engrosamiento difuso e irregular del epiplón mayor sugerente de “omental cake” o masa de tejido denso que ha sustituido totalmente la estructura grasa del epiplón (Figura 1).
A la paciente se le realizaron gastroscopia, colonoscopia mamografías que fueron normales. En la ecografía vaginal los anejos son de morfología y tamaño normales. Se solicito tomografía con emisión de positrones en la que se describe una hipercaptación de la pared anterior del hemiabdomen derecho (Figura 2).
Se realiza laparotomía media exploradora donde se evidencia bloque tumoral del epiplón con adherencias firmes del intestino delgado e hígado sin presencia de metástasis macroscópicas visibles. (Figura 3) En la biopsia intraoperatoria es positivo para adenocarcinoma. Se efectúa resección del 95% del epiplón con conservación del intestino delgado. A la semana de la intervención se traslada a la paciente a un centro hospitalario de referencia en cirugía radical peritoneal donde se desestimó reintervención por considerar que era suficiente la resección de la primera cirugía. Posteriormente la paciente recibió tratamiento adyuvante con quimioterapia administrándole de inicio la combinación recomendada de Taxanos con carboplatino (carboplatino paclitaxel). El resultado de la Anatomía Patológica fue de carcinoma papilar seroso primario del peritoneo.
A los cuatro meses reingresa por dolor abdominal y vómitos ocasionales con disconfort abdominal y distensión. En el TAC de control recidiva tumoral con pequeños implantes micronodulares mesentéricos y en el resto del epiplón sugerente de carcinomatosis sin presencia de ascitis. Se inicia un nuevo ciclo de quimioterapia incluyendo un tercer medicamento como es el Irinotecan. La paciente fallece un mes después del reingreso por carcinomatosis difusa y cuadro de obstrucción intestinal de origen tumoral.

Figura 1.- Engrosamiento del epiplon.

Figura 2.- Hipercaptación del epiplón.

DISCUSIÓN
El carcinoma seroso papilar representa el 1-2% de todos los canceres peritoneales primarios, por tanto se trata de una patología rara de baja frecuencia, considerablemente más baja que el carcinoma seroso papilar del ovario (1).
La característica principal del CPSPP es la afectación peritoneal difusa con mínima o ninguna afectación ovárica, nuestra paciente en el momento del diagnóstico solamente presentaba afectación masiva del epiplón mayor sin difusión peritoneal, parietal ni visceral.
El cáncer primario de peritoneo ocurre casi exclusivamente en mujeres, aunque se han descrito dos casos en varones (9) sin antecedentes de exposición al asbesto. En un estudio realizado por Halperin y col (10) hace referencia a que las mujeres con CPSPP tienen una menarquía más temprana, mayor número de embarazos y más baja incidencia familiar para el cáncer ginecológico que en mujeres con neoplasias de ovario. Las mujeres con mutación del BRCA1 tienen más riesgo de desarrollar CPSPP en un 5-10% y tienen sobreexpresión de p53. Parece que son tumores hormono dependientes.
Un grupo de Oncología Ginecológica GOG estableció ciertos criterios para el diagnóstico:
• Ovarios de tamaño normal menores o igual a 3 cm o aumentados de tamaño por proceso benigno.
• Ausencia de compromiso ovárico o limitado a la superficie.
• Histología de tipo seroso.
• Volumen de afectación extra ovárica significativamente mayor que de ovario.
Los síntomas clínicos son variados (Tabla I). Nuestra paciente al ingreso solo presentaba dolor abdominal inespecífico y distensión abdominal sin otra sintomatología acompañante.
La elevación del CA 125 está presente en más del 90% (> de 35.0 µgr/ml) (12), no obstante este dato no es diagnóstico de carcinoma peritoneal, dado que aparece en el 1% de la población sin afectación tumoral como en pacientes cirróticos. Es útil en el seguimiento y evolución de la enfermedad en los pacientes intervenidos quirúrgicamente. No se ha demostrado la utilidad de otros marcadores tumorales para este tipo de neoplasia.
La diseminación se produce de forma transperitoneal. El sitio más frecuente y común es el epiplón en 90-100% (Tabla II), sin embargo, nuestra paciente desarrolla la neoplasia en el epiplón mayor con posterior diseminación al peritoneo.
El diagnóstico se efectúa con técnicas de imagen como Radiología simple de tórax para descartar metástasis. Ecografía abdominal y TAC con signos de engrosamiento peritoneal nodular focal o difuso, omental cake, masas irregulares, ascitis, derrame pleural, calcificaciones del tumor, adenopatías y ovarios normales (13). Determinación del CA125 es útil para el diagnostico (14). Altras y col. (15) consideran que los valores de este marcador se correlacionan con el estadio y las respuestas al tratamiento.
Se debe realizar diagnostico diferencial con el mesotelioma maligno, linfomatosis, carcinoma metastásico de ovario y con menor frecuencia metástasis de carcinoma de estomago, colon, mama o páncreas.
El tratamiento de elección es la cirugía de citorreducción que en el 98% debe ser extensa por tumor diseminado. Debe incluir histerectomía, salpingooforectomía bilateral, omentectomía, resección intestinal solo para prevenir la obstrucción intestinal y esplenectomía. El objetivo del tratamiento es realizar cirugía, citorreducción óptima con enfermedad residual menor de un centímetro de diámetro, esta cirugía se consigue solo en menos del 50% de los casos (33-69%) (14). En el caso de nuestra paciente solo efectuamos resección del tumor porque se trasladaba a un hospital de referencia para cirugía radical total R0 que posteriormente se desestimó en dicho hospital. La terapia neoadyuvante utiliza el cisplatino, actualmente se recomienda la combinación de dos quimioterápicos como el carboplatino/paclitaxel y se está estudiando últimamente si es beneficiosa la asociación de un tercer quimioterápico como la ciclofosfamida o el irinotecan (16). La supervivencia media es de 7-24 meses, siendo la tasa de supervivencia a los 5 años del 0-22%.
Concluimos diciendo que el CPSPP es una neoplasia poco frecuente que representa el 1-2% de todos los cánceres peritoneales. Se debe hacer diagnostico diferencial con la carcinomatosis de ovario. Se debe sospechar si hay una elevación del CA 125 con ovarios normales. El tratamiento es la cirugía de citorreducción óptima asociado a quimioterapia. Tienen mal pronóstico con una supervivencia media muy baja.


BIBLIOGRAFÍA
1. Goodman MT, Shvetsov YB. Incidence of ovarían, peritoneal and fallopian tube carcinomas in the United States 1995-2004. Cancer Epidemiol Biomarkers. Prev 2009; 18:132-9.
2. Swerdlow M. Mesotelioma of the pelvic peritoneum resembling papillary cystoadenocarcinoma of the ovary: case report. Am J Obstet Gynecol 1959; 77: 197-200.
3. Kannerstein M, Churg J, Mc Cayghey WTE, Hill DP. Papillary tumors of the peritoneum in women: mesothelioma or papillary carcinoma. Am J Obstet Gynecol 1977;127:306-14.
4. Demir MK, Aker FV, Koksal N. Primary Serous Papillary carcinoma of the peritoneum. Radiology 2006; 240:905-9.
5. Lauchlan SC. The secondary müllerian system. Obstet Gynecol Surv 1972;27:133-46.
6. Menezer J, Chetrit A, Barda G, Lubin F, Fishman A, Dgani R et al. Primary peritoneal carcinoma-uterine involvement and hysterectomy. Gynecol Oncol 2006; 100:565-9.
7. Eltabbakh GH, Piver MS. Extraovarian primary peritoneal carcinoma. Oncology 1998;12:813-9.
8. White CD. Papillary intraperitoneal neoplasia resembling ovarian carcinoma after removal of bening ovaries. W.V Med J 1993;89:282-3.
9. Shmeuli E, Leider-Trejo L, Schwartz I et al. Primary papillary seros carcinoma of the peritoneum in a man. Ann Oncol 2001;12:563-7.
10. Halperin R, Zchevi S, Langer et al. Primary peritoneal serous papillary carcinoma: a new epidemiologic trend? A matched-case comparision with ovarian serous papillary cancer. Int J Gynecol Cancer 2001; 11: 403-8.
11. Iavazzo C, Vorgias G, Katsoulis M, Kalinoglou N, Dertimas V, Akrivos T. Primary peritoneal serous papillary carcinoma: clinical and laboratory characteristics. Arch Gynecol Obstet 2008; 278: 53-6.
12. Goff B. Primary peritoneal cancer. Eh: Gershenson DM. Gynecologic cancer: controversias in management. Philadelphia Elsevier 2004: 527-41.
13. Chion SY, Shen MH, Wang JH, Chang CY. Peritoenal serous papillary carcinoma: a reappraisal of CT imaging features and literature review. Abdom Imaging 2003; 28:815-9.
14. Killackey MA, Davis AR. Papillary serous carcinoma of the peritoneal surface: Matched-case comparision with papillary serous ovarian carcinoma. Gynecol Oncol 1993;51:171-4.
15. Altras MM, Aviram R, Cohen I. Primary peritoneal papillary seros adenocarcinoma: clinical and management aspects. Gynecol Oncol 1991;40:230-6.
16. Micha JP, Goldtem BH, Rettermaier MA et al. A phase II study of outpatient first-line paclitaxel, carboplatin and becacizumab for advanced-stage epithelial ovarian, peritoneal a fallopian tube cancer. Int J Gynecol cancer 2007;17: 771-6.
CORRESPONDENCIA:
Mª Belén Rodríguez Sanz
Servicio de Cirugía General y del Aparato Digestivo. Complejo Asistencial de Ávila
Avenida Juan Carlos I, s/n • 05071 ÁVILA
brosanz@yahoo.es
Tel.: 646.874.565 • 983.243.718


