Desgarro mucoso profundo yatrogénico en paciente con esofagitis eosinofílica
Alcaide N, Lorenzo S, Berroa E, González G, Tafur C, Macho A, del Olmo L, González JM
Servicio de Aparato Digestivo.
Hospital Clínico Universitario de Valladolid.
Trabajo enviado: 11/02/2015
Aceptado para su publicación: 30/03/2015
Correspondencia:
Noelia Alcaide Suárez
Servicio de Aparato Digestivo.
Hospital Clínico Universitario
C/ Ramón y Cajal 3 • 47005 Valladolid, España
Tel: 983 42 00 00 ext 86270
CASO CLÍNICO
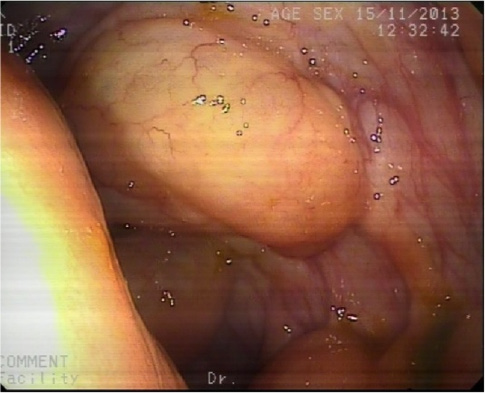
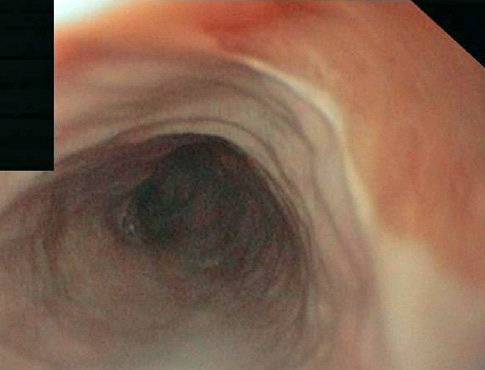
Paciente de 22 años diagnosticado siete años antes de enfermedad celiaca con adecuada respuesta a dieta sin gluten. En revisión rutinaria y aludiendo antecedentes familiares de primer grado de esofagitis eosinofílica (EoE), refiere disfagia de años de evolución y episodios de impactación alimentaria por los que nunca había tenido que acudir a urgencias. Se realiza gastroscopia tras tratamiento con inhibidores de la bomba de protones a altas dosis durante ocho semanas. En ella, se encuentra el esófago difusamente anillado, corrugado, con estrías longitudinales y exudados, hallazgos endoscópicos sugestivos de EoE. Se continúa con el procedimiento y se procede a tomar biopsias duodenales para comprobar respuesta histológica al gluten. En retirada, se observa de 33 a 40 cm de arcada dentaria, desgarro mucoso profundo producido por el decúbito del endoscopio mientras se completaba la realización de la gastroscopia (Figuras 1 y 2) y se procede a tomar biopsias del esófago distal y proximal. El paciente presenta buen estado general tras la exploración y no refiere dolor torácico ni disfagia. Se mantiene tratamiento con inhibidores de la bomba de protones a altas dosis y se le indica acudir a urgencias ante posibles incidencias. Evoluciona de manera favorable y las biopsias confirman el diagnóstico de EoE.
DISCUSIÓN
La EoE es una enfermedad crónica, inmune y mediada por antígenos que produce síntomas relacionados con disfunción esofágica (1). Histológicamente, presenta una infiltración crónica de eosinófilos y la formación de fibrosis a nivel subepitelial que conlleva la aparición de anillos esofágicos y estenosis (2). Afecta principalmente a varones con historia personal de procesos alérgicos y causa síntomas como disfagia, impactación alimentaria, odinofagia, pirosis y dolor torácico o abdominal (3). Clásicamente, los hallazgos endoscópicos que presentan estos pacientes, aunque inespecíficos, son anillos, surcos longitudinales, exudados blanquecinos, edema, fragilidad mucosa o estenosis (4) aunque pueden encontrarse ausentes hasta en un 30% (5). Presentan una mayor fragilidad de la mucosa esofágica con menor distensibilidad de la pared (6) con riesgo aumentado de desgarros mucosos y de perforación en el contexto de procedimientos diagnósticos y/o terapéuticos (7) o incluso de manera espontánea (8, 9). Sin embargo, la dilatación esofágica se considera un tratamiento eficaz y seguro que puede ocasionar desgarros mucosos, dolor torácico y odinofagia pero que no tiene aumentado el riesgo de perforación con respecto a otras causas de estenosis esofágica (10). No obstante, es importante extremar las precauciones en procedimientos endoscópicos en estos pacientes por la posibilidad de complicaciones graves derivadas de la instrumentación (11).
BIBLIOGRAFÍA
1. Molina-Infante J, Lucendo AJ. Eosinophilic esophagitis: a practical approach to diagnosis and management. Expert Rev Gastroenterol Hepatol 2014;8:925-34.
2. Ali Ma, Lam-Himlin D, Voltaggio L. Eosinophilic esophagitis: a clinical, endoscopic and histopathologic review. Gastrointest Endosc 2012;76:1224-37.
3. Furuta GT, Liacouras CA, Collins MH, Gupta SK, Justinich C, Putnam PE, et al. Eosinophilic esophagitis in children and adults: a systematic review and consensus recommendations for diagnosis and treatment. Gastroenterology 2007;133:1342-63.
4. Liacouras CA, Furuta GT, Hirano I, Atkins D, Attwood SE, Bonis PA, et al. Eosinophilic esophagitis: updated consensus recommendations for children and adults. J Allergy Clin Immunol 2011;128:3-20.
5. Liacouras CA, Spergel JM, Ruchelli E, Verma R, Mascarenhas M, Semeao E, et al. Eosinophilic esophagitis: a 10-year experience in 381 children. Clin Gastroenterol Hepatol 2005;3:1198-206.
6. Sgouros SN, Bergele C, Mantides A. Eosinophilic esophagitis in adults: a systematic review. Eur J Gastroenterol Hepatol 2006;18:211-7.
7. van Rhijn BD, Curvers WL, Bergman JJ, Verheij J, Bredenoord AJ. Esophageal perforation during endoscopic removal of food impaction in eosinophilic esophagitis: stent wellspent? Endoscopy 2014;46 Suppl 1 UCTN:E193-4.
8. Gómez Senent S, Adán Merino L, Froilán Torres C, Plaza Santos R, Suárez de Parga JM. Rotura esofágica espontánea como inicio de una esofagitis eosinofílica. Gastroenterol Hepatol 2008;31:50-1.
9. Vernon N, Mohananey D, Ghetmiri E, Ghaffari G. Esophageal rupture as a primary manifestation in eosinophilic esophagitis. Case Rep Med 2014;2014:673189.
10. Jacobs JW, Jr., Spechler SJ. A systematic review of the risk of perforation during esophageal dilation for patients with eosinophilic esophagitis. Dig Dis Sci 2010;55:1512-5.
11. Benítez Cantero JM, Benítez Benítez Cantero JM, Angel Rey JM, Rodríguez Perálvarez M, Ayllón Terán MD, Jurado García J, Soto Escribano P, Hervás Molina AJ, Poyato González A,González Galilea A. Perforación esofágica tras biopsia en paciente con esofagitis eosinílica. Gastroenterol Hepatol 2011;34:460-3. z

Figura 1.- Desgarro mucoso producido de manera yatrogénica por el decúbito del endoscopio sobre el esófago durante la realización de la gastroscopia de un paciente con esofagitis eosinofílica.

Figura 2.- Detalle del desgarro mucosa profundo producido de manera yatrogénica en un paciente con esofagitis eosinofílica. Detalle del desgarro mucosa profundo producido de manera yatrogénica en un paciente con esofagitis eosinofílica.