Intususcepción colo-cólica en el adulto. Aportación de dos casos.
Mª Belén Rodríguez Sanz
Servicio de Cirugía General y del Aparato Digestivo. Complejo Asistencial de Avila.
Correspondencia:
Paseo de Zorrilla 155, 3ºC
47008 Valladolid
Tel: 646 874 565 • 98 324 37 18
E-mail: brosanz@yahoo.es
RESUMEN
La invaginación intestinal en el adulto es una patología rara, supone el 5% de todas las invaginaciones y el 1% de las causas de obstrucción intestinal. A diferencia de la edad pediátrica, en el 90% de los casos tiene una etiología definida por lesión orgánica del intestino y sólo en el 10% de los casos son idiopáticos.
Presentamos dos casos de invaginación colo-cólica diagnosticados mediante TAC abdominal.
Palabras clave: Invaginación intestinal. Obstrucción intestinal.
INTRODUCCIÓN
La intususcepción se define como la introducción de un segmento del intestino proximal o intususceptum en un segmento distal adyacente del intestino o intususcipiens siguiendo los movimientos peristálticos del intestino (1,2). El mesenterio del intestino proximal también es atraído hacia el intestino distal que ocasiona compresión y obstrucción del drenaje venoso con el consiguiente edema de la pared intestinal.
La intususcepción intestinal en el adulto fue descrita por primera vez por Barbette en 1674 y en 1871 fue llevada a cabo la primera resección quirúrgica con éxito por Hutchinson (3).
La invaginación intestinal tiene una baja incidencia en el adulto, constituye el 5% de todas las intususcepciones incluidas las pediátricas y representa el 1% de las causas de obstrucción intestinal (4). Tiene una etiología demostrable en el 80-90% de los casos, siendo lesiones orgánicas de la pared intestinal las que actúan como cabeza de la invaginación (5).
CASOS CLÍNICOS:
Caso 1
Mujer de 50 años con antecedentes de litiasis renal, histerectomía por miomatosis uterina, ingresa por dolor abdominal y vómitos. Exploración física: dolor a la palpación en vacío derecho y epigastrio sin defensa ni peritonismo, sin masas ni megalias.
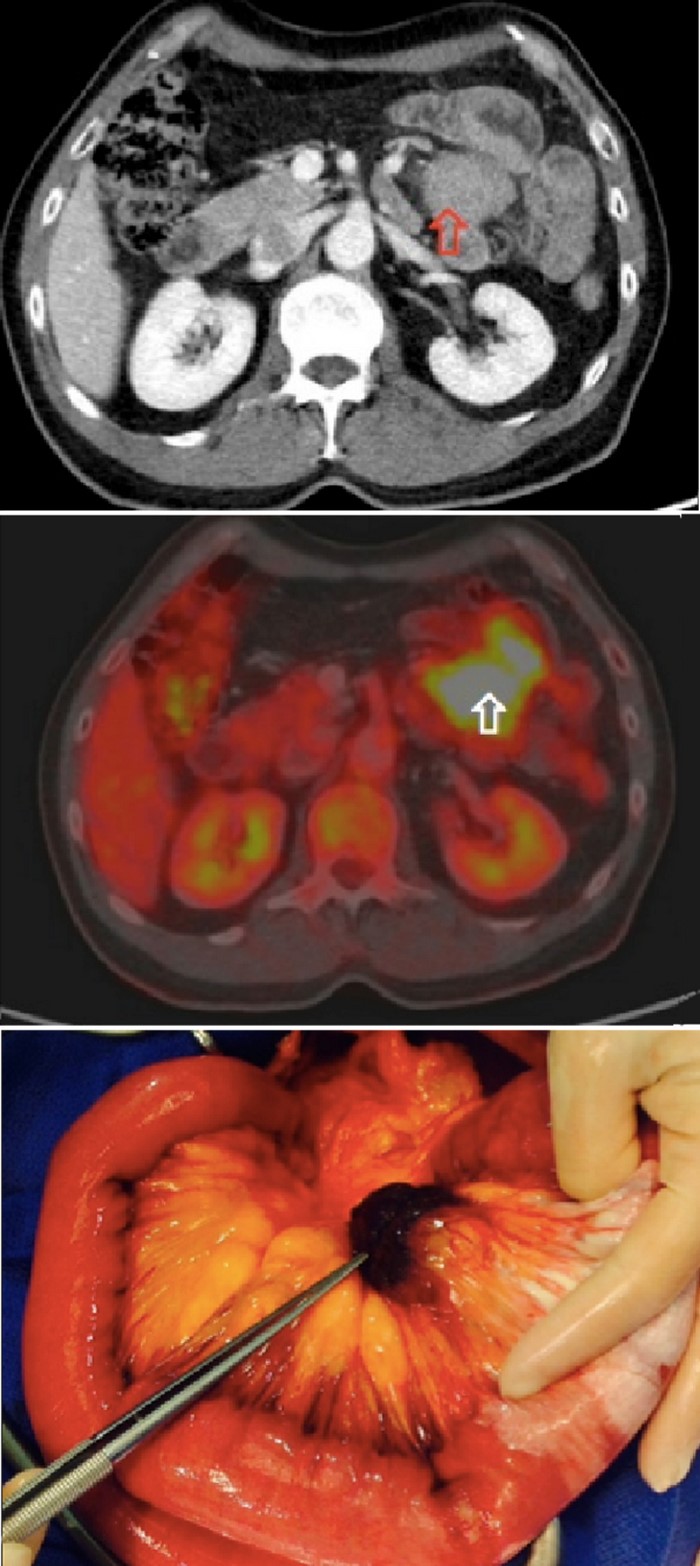
Pruebas complementarias: Leucocitosis. Ecografía abdominal: hígado, vía biliar y páncreas normales. Riñones con pequeñas litiasis sin dilatación de la vía excretora. En flanco izquierdo asas de delgado con efecto masa que podría corresponder a invaginación de delgado. TAC abdominal: masa lipoidea de 7 cm de diámetro longitudinal compatible con invaginación intestinal de delgado o colon transverso (Figura 1). Se realiza laparoscopia exploradora programada donde se evidencia obstrucción del colon transverso con masa de gran tamaño. Laparotomía con invaginación colo-cólica de transverso, se efectúa hemicolectomía derecha ampliada a transverso, ileotransversostomía latero-lateral con GIA- 60. Anatomía Patológica: lipoma de 7 cm en colon transverso que ocluye la luz intestinal. La paciente evoluciona favorablemente sin complicaciones.

Figura 1. Caso 1. TC corte longitudinal.
Caso 2
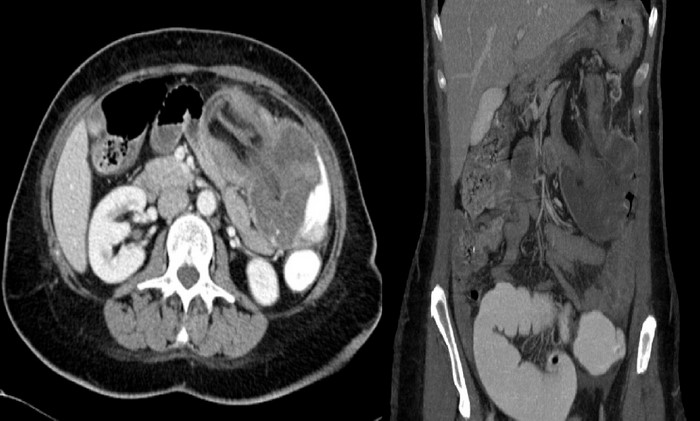
Varón de 79 años de edad con antecedentes de EPOC y enfermedad de Alzheimer. Ingresa por de dolor abdominal de 48 horas de evolución localizado en FII y vacío izquierdos sin nauseas ni vómitos. Ritmo intestinal conservado y rectorragia. Exploración física: Abdomen doloroso a la palpación en FII y vacío izquierdo con defensa abdominal y signos de irritación peritoneal. Pruebas complementarias: anemia crónica. Marcadores tumorales CEA, Ca19.9 y alfafetoproteína normales. Ecografía abdominal: en FII engrosamiento difuso del sigma con estenosis de la luz que podría corresponder a lipomatosis o invaginación. Colonoscopia: a 45 cm del margen anal neoformación con coágulos adheridos infranqueable. TAC abdominal: invaginación del colon descendente en el interior del sigma producido por una tumoración endoluminal irregular con perforación del colon (Figura 2).

Figura 2. Caso 2. TC corte sagital.
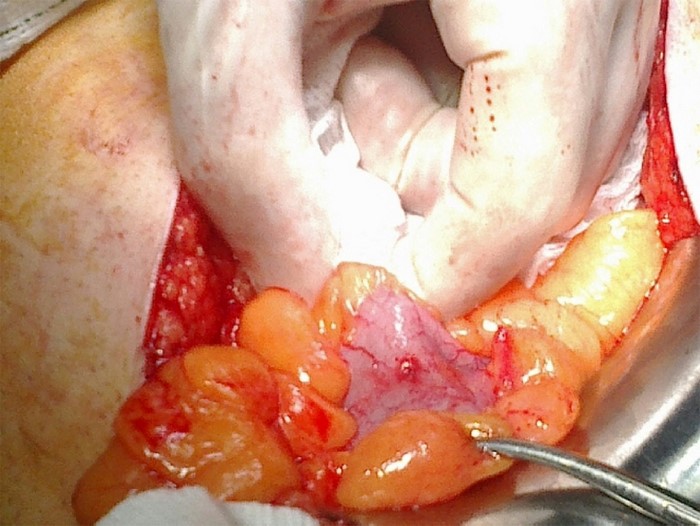
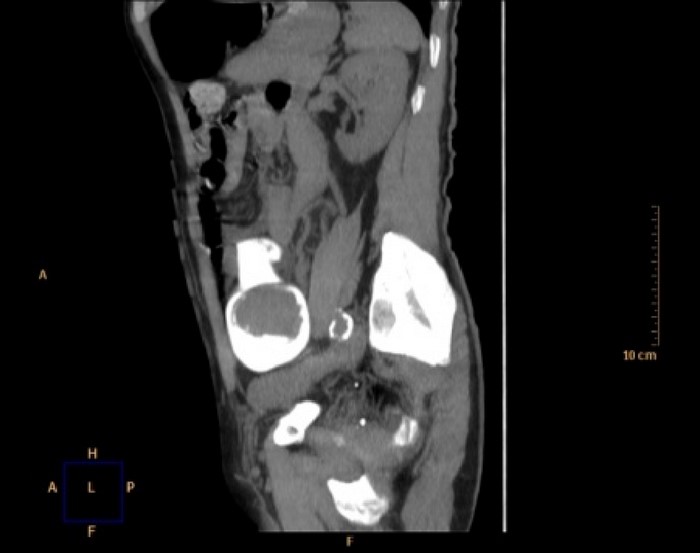
Tratamiento quirúrgico urgente mediante laparotomía media. Neumoperitoneo secundario a perforación de sigma por gran tumoración que ocasiona invaginación del colon descendente sobre el sigma. Sección del sigma y anastomosis T-T con CEEA-33. (Figuras 3 y 4). Anatomía Patológica: adenocarcinoma exofítico pediculado de 9×5 moderadamente diferenciado que infiltra toda la pared alcanzando la serosa y metastatiza en 5 de 23 ganglios linfáticos aislados. T4N2MX. Invaginación intestinal.

Figura 3. Caso 2. Laparotomía media.

Figura 4. Caso 2. Pieza quirúrgica.
DISCUSIÓN
La etiología más frecuente en el colon son procesos malignos en el 66% de los casos (7); entre los benignos más habituales destacan los lipomas y los pólipos.
La intususcepción puede ser clasificada por su localización en entéricas, íleo-cólicas o ileocecal y en colo-cólicas. La mayoría involucran al intestino delgado en un 75-80%, las invaginaciones colo-cólicas son muy poco frecuentes (8,9) y éstas de predominio sigmoido-rectal (10).
En nuestros dos casos se halló la causa de forma preoperatorio, la localización fue bien definida en el caso 2, mientras que en el caso 1 la localización fue determinada en la laparoscopia exploradora.
La presentación clínica es inespecífica, con más frecuencia es de carácter crónico con dolor abdominal cólico acompañado de nauseas y vómitos, a veces melenas semejando cuadro de obstrucción intestinal. Puede ir acompañada de diarrea sanguinolenta aunque en un número limitado de pacientes. Los signos más llamativos son la distensión abdominal y la palpación de una tumoración alargada, móvil y dolorosa en el 25-40% de los casos (11). Nuestros pacientes debutaron con cuadro clínico subagudo y agudo respectivamente.
El diagnóstico se debe realizar por imagen, entre los métodos más empleados están la ecografía y la TAC que tiene más sensibilidad y especificidad (1,12). La radiología simple de abdomen valora la gravedad y el nivel de la obstrucción intestinal. El enema de bario muestra la invaginación como un defecto de repleción en forma de copa a menudo acompañado por otro defecto de repleción que representa al tumor (7). La ecografía es la técnica de mayor rendimiento con un 100% de sensibilidad y un 80-93% de especificidad (8). En el corte sagital presenta una imagen en “pseudoriñón o sandwich” y en el corte axial una imagen en “diana, ojo de buey o donnuts” (13). La capa interna es hiperecoica (asa invaginada rodeada de mesenterio) y la capa externa hipoecoica (asa donde se ha producido la invaginación), también puede aparecer múltiples capas de ecogenicidad alternante (14). La TAC abdominal actualmente es la técnica de elección (15) ya que aporta la ventaja de identificar la causa de la intususcepción y valora la existencia de metástasis en otros órganos y la presencia de adenopatías. Hay tres patrones patognomónicos de invaginación intestinal visibles según el ángulo de corte:
- Patrón en diana: aparece en la fase más precoz e indica obstrucción incompleta. Se presenta en el corte transversal con densidad grasa periférica debido al mesenterio invaginado.
- Patrón en salchicha en el corte longitudinal.
- Patrón en pseudoriñón o masa bilobulada en la fase más severa debido al edema y compromiso vascular, tiene atenuación periférica alta debido a la pared intestinal adelgazada y áreas alternantes de baja y alta atenuación debido a la pared intestinal (16, 17,18).
La colonoscopia y la sigmoidoscopia son de ayuda. Los hallazgos son de una imagen “en rollito de primavera” (7).
El tratamiento recomendado y de elección es el quirúrgico y no el de reducción por la posibilidad de diseminación tumoral (19,20). Se debe realizar mediante abordaje laparoscópico aunque en los casos de obstrucción intestinal completa, la distensión de las asas y la fragilidad de la pared hacen que ésta técnica sea más difícil (11).
CONCLUSIONES
La invaginación intestinal colo-cólica es una patología muy rara en el adulto, siendo en el 66% de los casos de etiología maligna. El diagnóstico se debe efectuar mediante TAC abdominal y el tratamiento quirúrgico de elección debe ser siempre quirúrgico.
BIBLIOGRAFÍA
- López AM, Droguett E. Caso radiologico. Rev Chil Radiol 2003; 9:36-7
- Azar T, Berger D. Adult intussusception. Ann Surg 1997; 226:134-8
- Gordon RS, O´Dell KB, Namon AJ, Becker LB: Intussusception in the adult a rare disease. J Emerg Med 1991; 9: 337-42
- Pollack CV, Pender ES. Unusual cases of intussusception. J Emerg Med 1991; 9:347-55.
- Eisen LK, Cunningham JD, Anfses AH Jr: Intussusception in adults: institutional review. J Am Coll Surg 1999; 188: 390-5
- Desai N, Wayne MG, Tanb PJ, et al: Intussusception in adults. Mt Sinai J Med 1999; 66: 336-40
- Begos D, Sandor A, Modlin I: The diagnosis and management of adult intussusception. Ann Surg 1997; 1973: 88-94
- Martín JG, Aguayo JL, Aguilar J, Torralba JA, Lion R, Miguel J et al. Invaginación intestinal en el adulto. Presentación de 7 casos con énfasis en el diagnóstico preoperatorio. Cir Esp 2001; 69: 93-7
- Arthur AL, Garvey R, Vaness DG: colocloic intusssusception in a three- year old child casued by a colonia polyp. Cnn Med 1990; 54: 492-4
- B.Y. Huang and D.M. Warshauer. Adult intussusceptions: diagnosis and clinica relevance. Radiol Clin N Am 2003; 41:1137-51
- Alonso V, Targarona EM, Even Bendahan G, Kobus C, Moya I, Cherichetti C et al. Tratamiento laparoscópico de la intususcepción del intestino delgado en el adulto. Cir Esp 2003; 74: 49-59
- AG Bolado, O gorriño, P Ruiz, I Lecumberri and D Grande. Anisakiasis intestinal. Diagnóstico radiológico. Rev Esp Enferm Dig 2003; 95: 443-445
- Courtney SP, Ibrahim N, Longtaff AJ, Davidson CM. Intussusception in the adult: clinical, radiological and histological features. Postgrad Med J 1992; 68: 449-52
- David R, Anderson MD. The pseudokidney sign. Radiology 1999; 211: 395-7
- Gerald J, Ross MD, Venkata A, Milinemi MD. Jejuno jejunal intussuscpetion secondary to a lipoma. Radiology 2002; 216: 727-30
- Bondiaf M, Sayer P, tesemu C, Pelagre JP, Maissiat E, Rymer R. CT evaluation of small bowel obstruction. Radiographics 2001; 21: 613-24
- Cerro P, Magrini L, Porcari P, De angelis O, Macrini L. Sonographic diagnosis of intussusception in adults. Abdom Imaging 2000; 25: 45-7
- Warshauer DM, Lee JKT. Adult intussusception detected at CT or MR imaging: clinical imaging correlation. Radiology 1999; 21: 853-60
- A Ríos, M del Pozo Rodríguez, A Rubio Tejeo and M Vicente Cantero. Invaginación yeyunal por mieloma múltiple IgG. Rev Esp Enferm Digest 2005; 97: 839-40
- Welbaecher D, Bolin JA, Eran D, Orden W. intussusception in adults. Am J Surg 1971; 121: 531-5